Smertelindring ved renal denervering

Det er mulig å oppnå god smertelindring hos pasienter som gjennomgår katerebasert renal denervering.
Bakgrunn: Hypertensjon rammer rundt 25 prosent av den voksne befolkningen. Av disse utvikler opp til 10 prosent behandlingsresistent hypertensjon. En ny eksperimentell behandlingsmetode, kateterbasert renal denervering (RDN) er nasjonalt og internasjonalt under utprøving. Behandlingen anbefales gjennomført på våken pasient med lett sedering og smertelindring.
Hensikt: Hensikten med prosjektet er å utvikle og evaluere en kunnskapsbasert prosedyre for smertelindring under denne nye behandlingen.
Metode: Prosjektet er en delstudie til en prospektiv intervensjonsstudie hvor effekt av behandlingen undersøkes. Totalt 25 pasienter er inkludert. Data er samlet inn ved hjelp av et registreringsskjema utviklet spesifikt for prosjektet. Smerte er målt ved hjelp av numerisk bedømmelsesskala med svaralternativ fra 0 til 10 (NRS 11).
Resultat: Under behandlingen som varierte fra 50–90 minutter fikk pasientene i gjennomsnitt 22 mg morfin og 1,4 mg midazolam. Andelen av totaldosen morfin administrert før RDN varierte fra 43–98 prosent. Generell peroperativ smerte var i gjennomsnitt 3,2 og verste smertetoppene i gjennomsnitt på 6,0 på NRS 11. For 96 prosent var smertene under behandlingen mindre en forventet eller som forventet.
Konklusjon: Studien viser at det er mulig å gjennomføre RDN sikkert med våken pasient og uten anestesipersonell til stede. God informasjon til pasientene før behandlingen og godt kvalifisert personell er avgjørende for et godt resultat og en god opplevelse for pasienten.
Introduksjon
Mer enn 25 prosent av den voksne befolkningen i den vestlige
verden har diagnosen hypertensjon. Andelen forventes å øke
fremover. Ubehandlet hypertensjon gir betydelig økt risiko for
alvorlige følgesykdommer som hjerneslag, hjerteinfarkt, hjertesvikt
og nyresvikt. Den primære behandlingen er medikamentell (1,2). Noen
få, cirka 10 prosent, utvikler behandlingsresistent hypertensjon,
det vil si blodtrykk hvor man ikke oppnår blodtrykksreduksjon til
tross for multimedikamentell behandling (1,2).
Kateterbasert renal denervering (RDN) er en ny
behandlingsmetode for pasienter med behandlingsresistent
hypertensjon (1,2). Den første studien som beskrev metoden ble
publisert i Lancet i 2009 (1,3). RDN innebærer at man med
endovaskulær teknikk benytter radiofrekvensbølger og abladerer
eller «brenner» sympatiske nervefibre i nyrearteriene (1,3).
Til tross for stor entusiasme i begynnelsen, viser nye
resultater blant annet fra Tyskland at behandlingen ikke er like
effektiv for alle (4). RDN anbefales derfor i oppdaterte
retningslinjer forsøksvis i studier og/eller med oppfølging i
registre, til pasienter med alvorlig behandlingsresistent
hypertensjon (2,5). Det pågår for tiden internasjonalt flere
studier og fremtiden vil bringe mer kunnskap om hvilke pasienter
som har nytte og effekt av denne nye behandlingen (6).
Vellykket utført RDN skal lokalt ødelegge både efferente og
afferente sympatiske nerveender som ligger i veggen av
nyrearteriene, uten at det medfører skade og eventuelt
forsnevringer i åreveggen. Prosedyren er beskrevet som smertefull
og man antar at smertene skyldes varmen på grunn av «brenningene» i
åreveggen (3). Pasienter har beskrevet en dyp særegen, ikke
utstrålende smerte i mage og lumbalregionen (3, 7). Generell
anestesi er foretrukket ved enkelte sentere som gjennomfører
behandlingen. Ettersom enkelte tilfeller med vasovagale reaksjoner
med bradykardi og hypotensjon er observert etter bolusinjeksjon med
opioid, har man ønsket å utføre prosedyren med kun lett sedering;
det vil si på våken pasient. Man ønsker å sikre optimal
pasientkomfort og optimale forhold for intervensjonen. Med hensyn
til nøyaktig plassering av ablasjonskateter er det anbefalt god
smertelindring med opioider minst to minutter før behandlingen,
eventuelt lett sedering og godt samarbeid mellom anestesiolog og
kardiolog (3).
De siste 20 årene har det skjedd en utviklig internasjonalt med
prosedyrer som gjennomføres ved hjerteavdelingers laboratorier,
blant annet koronare invasive undersøkelser og
behandlingsprosedyrer. Som følge av dette har man sett en økt
utbredelse av sykepleieadministrert sedasjon og smertelindring (8,
9). En systematisk oversiktsartikkel konkluderer med at
sykepleieadministrert sedasjon og smertelindring ved lett sedering
er trygt og forbundet med lav risiko for komplikasjoner ved
kardiologiske laboratorier (9). For å oppnå et godt resultat
anbefaler man god opplæring og dedikert personell som observerer
pasientene under sedasjonen (8,9).
Ved Universitetssykehuset Nord-Norge (UNN) ble det i 2011
startet et pilotprosjekt (1) og deretter i 2013 en studie hvor man
evaluerer effekten av RDN. Effektmålene er i tillegg til
hypertensjon; glukosemetabolisme, hypertensiv organskade,
livskvalitet og arytmitendens. Studien er registrert ved
www.clinicaltrials.org med identifikasjonsnummer NCT01630928.
I tilknytning til studien ble det gjennomført et systematisk
forbedringsprosjekt på smertelindring under RDN. Hensikten med
prosjektet var å utvikle og evaluere, ved hjelp av systematisk
metodikk fra forskningsprosessen, en kunnskapsbasert prosedyre for
smertelindring under denne nye eksperimentelle behandlingen.
Hovedproblemstillingen vi undersøker er om vi ved hjelp av
sedasjon på våken pasient og avdelingens eget personale, kan oppnå
adekvat smertelindring under behandlingen hvor tilstedeværelse av
anestesipersonell ikke er nødvendig. For å besvare
problemstillingen har vi undersøkt følgende spørsmål:
Hva kjennetegner RDN med hensyn til antall behandlinger og
varighet?
Hva kjennetegner behandlingen med hensyn til pasientens
forventninger, smerteskår og bivirkninger?
Hvor mye smertestillende får pasientene før og under
behandlingen?
Er det sammenheng mellom mengde morfin, rapportert smerter og
påvirket respirasjon i form av fall i oksygenmetning og
respirasjonsfrekvens?
Er det sammenheng mellom pasientens vekt, mengde morfin og
smerteskår?
Systematisk prosedyreutvikling
I prosjektet har vi benyttet trinnene fra «Forbedringsmodellen i
praksis» hvor Demnings kvalitetshjul PDSA (Plan – Do – Study – Act)
inngår (10). Før vi kunne utvikle prosedyren ble det gjennomført en
litteraturgjennomgang som første trinn i prosessen. Vi fant her en
anbefaling fra England og en pilotstudie fra Frankrike. Ifølge The
Joint UK Societies´ Consensus statements on Renal Denervation for
Resistant Hypertension, anbefales det at pasienter før prosedyren
får informasjon om at den kan være smertefull (5). Videre anbefaler
man analgetisk og sederende premedikasjon og samme medikasjon,
eventuelt anestesi, under prosedyren. Premedikasjonen som er
foreslått inkluderer midazolam, opioid og antiemeticum på våken
pasient (5). I den franske pilotstudien, hvor tolv pasienter var
inkludert, ble det foreslått et alternativ til generell anestesi
med antihistamin, opioid og en gassblanding bestående av oksygen og
lystgass (MEOPA) (11). Forfatterne konkluderte med at pasientene
som fikk en gjennomsnittsdose morfin på 0,11 mg/kg sammen med
lystgass, i mye mindre grad opplevde smerter peroperativt
sammenliknet med dem som bare fikk medikamenter og ikke
gassblandingen (11).
I utviklingen av prosedyren bygget vi videre på vår avdelings
kvalitetsarbeid med utvikling av prosedyre for smertelindring ved
atrieflimmerablasjon (12) som er basert på WHO´s smertetrapp og har
følgende førende prinsipper (12):
- Start med premedikasjon med perifert virkende smertestillende
- Tilfør kontinuerlig sentraltvirkende smertestillende under prosedyren
- Gi tillegg av bolusdoser ved smertetopper
- Gi sederende legemidler tidlig slik at pasienten slapper godt av
- Benytt en multimodal tilnærming (informasjon, oppmuntring, fukte munn, osv.)
- En sykepleier skal være til stede under hele prosedyren
Med hensyn til legemidler, fant Tollefsen og kollegaer at
kombinasjonen midazolam og fentanyl var å foretrekke framfor
propofol (12). Dette fordi propofol var rapportert å ha
kardiopulmonale bivirkninger og kunne forårsake uro og hoste hos
pasienten. Dette kunne igjen føre til lengre prosedyretid (12).
Disse erfaringene førte vi videre til vår
smertelindringsprosedyre.
Siden behandlingen skulle gjennomføres på hjertemedisinsk
laboratorium, valgte man sammen med kardiologene å benytte våken
sedasjon i henhold til internasjonale anbefalinger (3,9). Våken
sedasjon «conscious sedation» innebærer at pasienten er våken eller
sover lett, responderer på verbal eller fysisk stimulering, selv
opprettholder frie luftveier og har upåvirket kardiovaskulær
funksjon (8). Det er ikke anestesipersonale ansatt ved
hjertemedisinsk laboratorium og morfin ble derfor valgt som opioid.
Medikamentene som, i samråd med anestesilege ble benyttet i
prosjektet, er beskrevet i boks 1:

Metode
Design og deltakere
Pasientene som gjennomgikk RDN var deltakere i en prospektiv
intervensjonsstudie «The ReShape CV-Risk Study». Studien var uten
kontrollgruppe og inkluderte totalt 25 pasienter, rekruttert i
tidsrommet fra mars 2013 til mars 2014. I denne aktuelle delstudien
er alle de 25 som først ble inkludert i hovedstudien deltakere.
Inklusjonskriteriene i intervensjonsstudien var alder 18–68 år
og behandlingsresistent hypertensjon påvist ved 24 timer
hypertensjons (BT) måling med systolisk BT (SBT) på dagtid over 135
mmHg, til tross for behandling med fire eller flere
antihypertensive medikamentgrupper. De som hadde kjent sekundær
årsak til hypertensjon er ekskludert. I tillegg hadde vi følgende
eksklusjonskriterier: Bruk av antidiabetisk medikament, eller kjent
type 1 og type 2 diabetes; hemodynamisk signifikant aortastenose;
implantert pacemaker eller implantert defibrillator; behov for
medisinering som ikke kan seponeres midlertidig under intervensjon;
alvorlig kontrastallergi; kreftsykdom siste fem år;
nyretransplantert; graviditet og bruk av p-piller. To av de
inkluderte pasientene i hovedstudien ble ekskludert slik at denne
totalt følger opp 23 pasienter.
Prosedyre
Alle pasientene fikk grundig informasjon om behandlingen av
kardiolog. Dette innebar informasjon om selve prosedyren og
potensielle komplikasjoner som kunne oppstå per- og postoperativt.
Spesielt er det lagt vekt på å forberede studiepasientene på at
dette er en smertefull behandling på grunn av energien fra
radiobølgene, men at det blir gitt smertestillende medikamenter
underveis. Videre er de informert om ønsket effekt av behandlingen,
samt at ikke alle som gjennomgår behandlingen vil oppnå ønsket
effekt.
Behandlingen er gjennomført i henhold til guidelines ved å føre
et ablasjonskateter inn via en perkutan tilgang i arteria femoralis
communis og opp til nyrearteriene. Kateteret er tilkoplet en
radiobølgegenerator. For å få kateteret riktig plassert, benyttes
røntgenkontrast og røntgenstråler. RDN utføres punktvis i
spiralform longitudinalt i nyrearteriene via en elektrode på enden
av dette kateteret. Behandlingstiden er to minutter på hvert punkt
i arterien og det brukes inntil 8 watt for å få optimal
nervedestruksjon og minst mulig affeksjon av karveggen (5).
Generatoren ivaretar pasientsikkerheten ved at den avbryter
behandlingen hvis det blir for varmt eller hvis kateteret ikke
ligger tett opp mot karveggen (3). Når behandlingen er avsluttet,
fjernes kateter og innfører, og arterien lukkes med kollagenpropp
eller ved hjelp av kompresjon (3,5).
Premedikasjon er gitt per os til alle pasientene, to til tre
timer før pasienten ankom laboratoriet. Ved ankomst er det gitt en
pose krystalloid løsning intravenøst, samtidig med en infusjon av
morfin 1 mg/ml. Midazolam 1–2 mg er titrert inntil pasienten er
godt avslappet, samtidig som paracetamol er administrert i henhold
til boks 1. Totalt 20–30 minutter er benyttet til
medikamentadministrering samtidig som en annen sykepleier har gjort
pasienten klar til behandlingen. Det er tilstrebet å komme opp i en
dose på cirka 15–20 mg morfin før RDN starter slik at pasienten
unngår smertetoppene. Morfininfusjonen stoppes 5–10 minutter før
forventet prosedyreavslutning. To intensivsykepleiere har rullert
på å ha ansvar for pasientene under prosedyren. Pasientens uttrykk
for smerter, over- og undersedering er registrert og han eller hun
er overvåket for tidligst mulig å oppdage vitale tegn på
kardiopulmonale bivirkninger.
Datainnsamling
For å kunne evaluere prosedyren, er data samlet inn etter mal
fra registreringsskjemaet som er utarbeidet i forbindelse med
atrieflimmerprosjektet (12). I tillegg er opplysninger om alder
høyde og vekt hentet fra kurve og kliniske variabler innhentet ved
inklusjon i hovedstudien.
I kartleggingen av smerte har vi brukt et
smertekartleggingsverktøy med numerisk bedømmelsesskala (numeric
rating scale – NRS 11), fra 0–10, hvor 0 var ingen smerte og 10 var
verst tenkelige smerte. Denne unidimensjonale smertebedømmelsen er
det mest anvendte instrumentet for voksne i ulike settinger og er
vurdert som enkelt å svare på av pasienter (13,14).
Etter gjennomført RDN er pasientene spurt om å angi
gjennomsnittlig smerte under inngrepet og smerte på verste
smertetopp, begge på den samme NRS-skala fra 0–10. Videre spurte vi
hvordan opplevelsen var i forhold til forventet; mer smertefullt,
mindre smertefullt eller som forventet. Andre spørsmål var om de
hadde vært kvalme eller hadde hatt annet ubehag. Prosedyrerelaterte
variabler som BT, puls, oksygenmetning (SPO2) og
respirasjonsfrekvens ble målt før oppstart og ved regelmessige
intervaller gjennom hele behandlingen. Medikamenter og andre
prosedyredetaljer slik som antall behandlinger, ble også
registrert.
Dataanalyse
Deskriptiv statistikk med sentralmål (gjennomsnitt) og spredningsmål (standardavvik (SD) er benyttet for å beskrive utvalg med hensyn til demografiske og kliniske variabler. For å undersøke sammenhenger mellom variabler er Spearman´s korrelasjonsanalyse utført. Students t-test er benyttet for å sammenlikne de to gruppene med fall i SPO2 under 5 med de med fall på 5 eller større. Alle analyser er gjennomført ved hjelp av statistikkprogrammet PASW statistical software versjon 21, og signifikansnivået er satt til p= 0,05.
Etikk
Hovedprosjektet er godkjent hos Regional komité for medisinsk og helsefaglig forskningsetikk og lokalt personvernombud.
Resultat
Av de totalt 25 deltakere var det fem kvinner og 20 menn. Alderen varierte fra 34 til 70 år, med en gjennomsnittsalder på 55 år. Demografiske og kliniske karakteristika er beskrevet nærmere i tabell 1. Som det fremkommer her sto deltakerne i gjennomsnitt på antihypertensive medikamenter i fem ulike medikamentklasser. To hadde tidligere koronarsykdom og fire hadde hatt tidligere hjerneslag. Av annen komorbiditet var det henholdsvis ett tilfelle for hver av diagnosene: Hjertesvikt, atrieflimmer, perifer arteriell sykdom og transiskemisk anfall (se tabell 1).
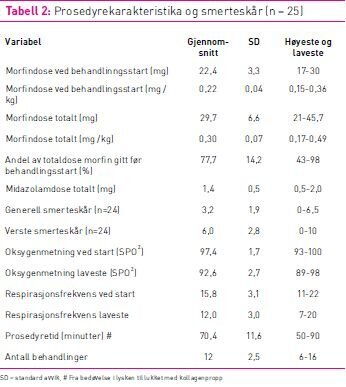
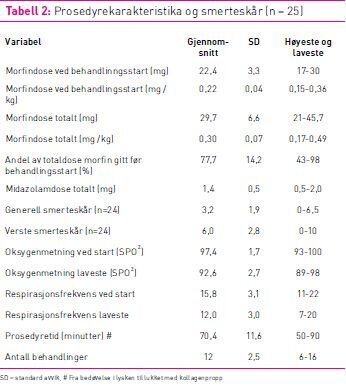
Total prosedyretid på laboratoriet varierte fra 50–90 minutter
med gjennomsnittstid 70 minutter og gjennomsnittlig 12 ablasjoner
(tabell 2). Pasientene fikk i gjennomsnitt 22,4 mg morfin før
behandlingsstart, som utgjør 0,22 mg/kg. Totaldosen morfin var i
gjennomsnitt på 0,30 mg/kg morfin (tabell 2). Andel av totaldosen
morfin gitt før RDN startet varierte fra 43–98 prosent.
Gjennomsnittlig midazolamdose var 1,4 mg varierende fra 0,5 til 2
mg. Generell peroperativ smerteskår varierte fra 0 til 6,5 og var
gjennomsnittlig 3,2. Verste smertetopp varierte fra 0 til 10 og var
i gjennomsnitt 6,0 (jamfør tabell 2).
Det ble registrert ett tilfelle med bivirkning under
behandlingen hvor en pasient hadde en vasovagal reaksjon med
bradycardi, kvalme og moderat hypotensjon. Hendelsen stabiliserte
seg raskt etter administrering av kvalmestillende legemiddel og økt
væskeinfusjon.
Respirasjonsfrekvensen under prosedyren varierte fra 7–20. I
fire tilfeller med respirasjonsfrekvens under 9 ble pasienten
stimulert. Ingen av pasientene fikk hypoksi med alvorlig SPO2 fall,
men fem pasienter var periodevis nede i 89 prosent under prosedyren
(tabell 2). På det åpne spørsmålet om pasientene hadde opplevd
andre plager, nevnte seks munntørrhet og en tørste. Med hensyn til
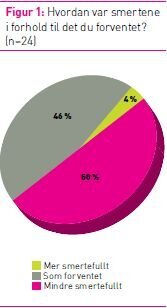
hvordan smerteopplevelsen totalt sett etter inngrepet var i forhold
til forventet, var det mer smertefullt for en pasient jamfør figur
1. For de øvrige var det som forventet eller mindre smertefullt (se
figur 1).
Analysene viste en signifikant sammenheng mellom verste
smerteskår og mengde morfin som ble gitt peroperativt (Spearman´s
rho 0,58, p=0,004); de som hadde mest smerter fikk mest morfin.
Videre viste analysene en signifikant negativ sammenheng mellom
mengde morfin gitt før ablasjonene startet og verste smerteskår
under behandlingen (Spearman´s rho = -0,4 p= 0,05); de som fikk
høyest andel morfin før prosedyrestart opplevde minst
smerter.
Vi rekodet fall i SPO2 metning til fall på mindre en 5 og til
fall på 5 og mer. Analyser viste at de som hadde minst metningsfall
hadde fått signifikant mer morfin enn de med metningsfall på 5 og
mer (33,6 versus 27,0 mg p= 0,01). De med størst metningsfall hadde
tilsvarende også fått signifikant mindre morfin før behandlingen
startet (21,3 versus 24,0 mg p=0,04). Mellom vekt, mengde morfin
totalt, smerter generelt og verste smerte var det positive, men
ikke signifikante korrelasjoner.
Diskusjon
Resultatene fra denne studien viser at RDN er mulig å
gjennomføre på en sikker måte med våken pasient, smertestilt med
intravenøs analgesi, og uten anestesipersonell til stede. Smerte
under prosedyren hadde et nivå med tilnærmet samme
gjennomsnittsskår og verste smerteskår som rapportert under
atrieflimmerablasjon (12). I internasjonal litteratur beskrives en
smerteskår på opp til 3 som mild smerte, en skår mellom fra 4–5 som
moderat og en smerte på 6–8 som alvorlig smerte på ulike
instrumenter hvor NRS 0–10 anvendes (14). I postoperative
retningslinjer er det anbefalt at NRS (0–10 skala) ikke overstiger
3 (15). Relativt ny norsk forskning viser at 40 prosent av
pasientene rapporterer en gjennomsnittssmerte som er større enn
eller lik 4 det første postoperative døgnet (16). Den
gjennomsnittlige smerteskåren på 3 og verste smertetoppen på 6 i
dette prosjektet vurderes derfor som akseptabel.
Til tross for kortere prosedyretid og mindre wattstyrke, viste
det seg at RDN er en mer smertefull prosedyre enn
atrieflimmerablasjon. Vi startet med samme morfindosering som ved
atrieflimmerbehandling i avdelingen, det vil si cirka 15 mg morfin
før behandlingsstart (12). Men vi erfarte tidlig at vi ikke
oppnådde ønsket effekt med denne doseringen. I samråd med
anestesilege ble morfindosen økt til i snitt 20 mg før
behandlingsstart, og vi oppnådde tilfredsstillende effekt.
Erfaringer viser at underbehandlet smerte er vanskeligere å
lindre etter hvert som tilstanden vedvarer. Derfor var det å komme
smerten i forkjøpet og ha en «grunnsmurning» i form av
premedikasjon, en god grunnsedering og analgesi, et viktig
prinsipp. Resultatene våre bekrefter dette og viser at de
pasientene som fikk mest morfin i forkant av prosedyren, hadde
mindre behov for morfin underveis. De unngikk de verste
smertetoppene.
Gjennomsnittsdose morfin gitt under prosedyren var høyere enn
den rapportert av Pansieri og kollegaer som benyttet morfin i
kombinasjon med MEOPA som et alternativ til generell anestesi (11).
Likevel var det i sistnevnte studie nødvendig med anestesipersonale
til stede, noe som ikke er tilgjengelig på vårt hjertelaboratorium.
Å utføre RDN på våken pasient har, på samme måte som ved
atrieflimmer, flere fordeler. Det gir færre kardiopulmonale
komplikasjoner, noe som optimaliserer forholdene for behandlingen
(17). Dette stemmer også med erfaringene fra atrieflimmerprosjektet
(12) og resultatene fra den systematiske oversiktsartikkelen om
sykepleieadministrert sedering og smertelindring på prosedyrer
gjennomført ved kardiologiske laboratorium (9).
Våken sedasjon med midazolam og morfin er ikke
komplikasjonsfritt. Det var kun ett tilfelle av kardiopulmonal
bivirkning som ble håndtert med enkle tiltak under prosedyren.
Dette krever at sykepleieren har tilfredsstillende opplæring, gode
rutiner for observasjon, overvåkning og en handlingsplan for
hendelser. Godt kvalifisert personale er rapportert som avgjørende
for et godt resultat og en god opplevelse for pasienten (8,9,18). I
dette prosjektet var det derfor to dedikerte intensivsykepleiere
med spesialopplæring som gjennomførte smertelindring og assistanse
under RDN-behandlingen. Erfaringsmessig frykter sykepleiere
komplikasjonen respirasjonsdepresjon ved administrering av morfin.
Dette er også i internasjonal litteratur identifisert som en viktig
barriere mot optimal smertelindring. Resultatet blir at pasientene
ikke er optimalt smertestilt under behandlingen (14). Resultatene
fra dette prosjektet viser at pasientene som var best smertestilt
var de som hadde mest adekvat respirasjon, definert som minst fall
i oksygenmetning. Likevel, respirasjonsdepresjon er en fryktet
komplikasjon hvor god handlingsberedskap av planlagte tiltak og
nøye observasjon av respirasjonsparametere må vektlegges særskilt
(3,8,9).
Pasientene var svært godt informerte på forhånd, både om selve
behandlingen og om hvor smertefullt dette kunne bli. De var veldig
motiverte for inngrepet, og ga uttrykk for at «de holder ut smerten
fordi de vet den er midlertidig» og i håp om helsegevinst.
Preoperativ informasjon som omfatter stikkordene hva, hvorfor og
hvordan, bidrar til at pasienten blir så trygg som mulig før det
forestående inngrepet (19). Til tross for en gjennomsnittskår på
verste smerte til 6, evaluerte de fleste pasientene
smerteopplevelsen som mindre smertefull enn forventet eller som
forventet. Dette viser at man lyktes i å gi god informasjon på
forhånd.
I dette prosjektet har vi altså bygget videre på den
standardiserte prosedyren som brukes til smertelindring under
atrieflimmerbehandling, og har oppnådd en god og adekvat
smertelindring også til pasienter som gjennomgår RDN. Ved å følge
en fastsatt prosedyre unngår man at smertelindringen varierer fra
sykepleier til sykepleier uavhengig av hvordan pasienten er i stand
til å uttrykke smerte og hvordan kontakten er mellom pasient og
sykepleier. For en av deltakerne fungerte ikke NRS-skalaen, for de
øvrige var dette et egnet redskap for å fange opp pasientens
smerteuttrykk.
Selv om denne studien kun har inkludert 25 deltakere mener vi
likevel at resultatene kan generaliseres med forsiktighet samtidig
som prosedyren fortsatt evalueres og forbedres. Ett
forbedringsområde vi ser er dosering ut fra kroppsvekt, som vi ikke
tok hensyn til i stor nok grad. Vi baserte oss på en
standarddosering av morfin hvor vi forsøkte å titrerte oss opp til
ønsket effekt i tråd med anbefalinger i internasjonale
retningslinjer (3). Titreringen gjør at dose/kg varierer fra
pasient til pasient. Ved å ha et mer bevisst forhold til pasientens
vekt når morfin doseres, vil vi kunne optimalisere smertelindringen
til de med høy kroppsvekt.
Videre forskning hvor opplevelse av forberedthet til
behandlingen, smertelindring under behandlingen, ubehag og plager
etter behandlingen og pasienterfaringer på kort og lang sikt
anbefales.
Konklusjon
Studien viser hvordan man ved hjelp av systematisk metodikk og
forskningsbasert kunnskap kan utvikle, evaluere og implementere ny
praksis for smertelindring samtidig som ny behandling prøves ut.
Erfaringene med prosjektet i praksis har medført en økt
bevisstgjøring og en mer aktiv holdning til smertelindring hos
sykepleierne på hjertelaboratoriet.
Når det gjelder renal denervering er det fremdeles en del
spørsmål som må besvares før behandlingen blir etablert i Norge.
Videre vet vi at utstyrs-leverandørene driver produktutvikling og
smertebildet vi ser i dag ved denne behandlingen, kan endre seg
noe. Det er viktig at man stadig søker å gi optimal sykepleie
basert på oppdatert kunnskap og standardisere både dokumentasjon-
og behandlingsprosedyrene. Dette gjør at praksis kan evalueres og
ny kunnskap lettere implementeres i en travel hverdag.
Referanser
1. Steigen TK, Toft I. Korttidsoppfølging av de første
pasientene behandlet med kateterbasert renal denervering i Norge.
Hjerteforum. 2012;25(1):44.
2. Mancia G, Fagard R, Narkiewicz K, Redon J, Zanchetti A, Bohm
M, et al. 2013 ESH/ESC guidelines for the management of arterial
hypertension: the Task Force for the Management of Arterial
Hypertension of the European Society of Hypertension (ESH) and of
the European Society of Cardiology (ESC). European heart journal.
2013;34 (28):2159–219.
3. Sapoval M, Azizi M, Bobrie G, Cholley B, Pagny JY, Plouin
PF. Endovascular renal artery denervation: why, when, and how?
Cardiovascular and interventional radiology. 2012;35(3):463–71.
4. Persu A, Jin Y, Fadl Elmula FE, Jacobs L, Renkin J, Kjeldsen
S. Renal denervation after Symplicity HTN-3: an update. Current
hypertension reports. 2014;16(8):460.
5. Caulfield M, de Belder M, Cleveland T, Collier D, Deanfield
J, Gray H, et al. The Joint UK Societies’ Consensus Statement on
Renal Denervation for Resistant Hypertension. 2012 [Nedlastet
12.06.2014]. Available from:
http://www.bcs.com/documents/The_Joint_UK_Societies_Consensus_on_Renal_Denervation_for_resistant_hypertension.pdf.
6. Schmieder RE, Redon J, Grassi G, Kjeldsen SE, Mancia G,
Narkiewicz K, et al. ESH position paper: renal denervation – an
interventional therapy of resistant hypertension. Journal of
hypertension. 2012;30(5):837–41.
7. Schlaich MP, Schmieder RE, Bakris G, Blankestijn PJ, Bohm M,
Campese VM, et al. International expert consensus statement:
Percutaneous transluminal renal denervation for the treatment of
resistant hypertension. Journal of the American College of
Cardiology. 2013;62 (22):2031–45.
8. Odom-Forren J. The evolution of nurse-monitored sedation.
Journal of perianesthesia nursing: official journal of the American
Society of PeriAnesthesia Nurses / American Society of
PeriAnesthesia Nurses. 2005;20(6):385-98.
9. Conway A, Page K, Rolley JX, Worrall-Carter L.
Nurse-administered procedural sedation and analgesia in the cardiac
catheter laboratory: an integrative review. International journal
of nursing studies. 2011;48(8):1012–23.
10. Schreiner A. Kom i gang. Kvalitetsforbedring i praksis.
Oslo: 2004.
11. Pansieri M, Barnay P, Larderet E, Krebs G, Aboukhoudir F,
Andrieu S, et al. [Renal denervation for resistant hypertension
without general anesthesia: advantage of a MEOPA morphine protocol.
Preliminary experience]. Annales de cardiologie et d›angeiologie.
2013;62(5):283–6.
12. Tollefsen T, Lyngmo S, Solheim T, Bjørsvik G, Tande PM,
Hanssen TA. Smertelindring og sedering ved atrieflimmerablasjon –
et systematisk forbedringsprosjekt ved Universitetssykehuset
Nord-Norge. Hjerteforum. 2013;26(3):23–8.
13. Hjermstad MJ, Fayers PM, Haugen DF, Caraceni A, Hanks GW,
Loge JH, et al. Studies comparing Numerical Rating Scales, Verbal
Rating Scales, and Visual Analogue Scales for assessment of pain
intensity in adults: a systematic literature review. Journal of
pain and symptom management. 2011;41(6):1073–93.
14. Welchek CM, Mastrangelo L, Sinatra RS, Martinez R.
Qualitative and Quantitative assessment of pain. In: R.S.S de
Leon-Casasola O., Ginsberg B., Viscusi E.R., editors. Acute Pain
Management. Cambridge: Cambridge University Press; 2009. p. 679.
15. Sjøveian AKH, Leegaard M. Hvordan kan sykepleieren fremme
pasientmedvirkning i postoperativ smertebehandling? Sykepleien
Forskning. 2012;7(4):380–7.
16. Fredheim OM, Kvarstein G, Undall E, Stubhaug A, Rustoen T,
Borchgrevink PC. [Postoperative pain in patients admitted to
Norwegian hospitals]. Tidsskrift for Den norske legeforening:
tidsskrift for praktisk medicin, ny raekke. 2011;131(18):1763–7.
17. Tang RB, Dong JZ, Zhao WD, Liu XP, Kang JP, Long DY, et al.
Unconscious sedation/analgesia with propofol versus conscious
sedation with fentanyl/midazolam for catheter ablation of atrial
fibrillation: a prospective, randomized study. Chinese medical
journal. 2007;120 (22):2036–8.
18. Altmann D, Hindricks G, Arya A, Piorkowski C, Gaspar T,
Eitel C, et al. Management of patients pre-, per- and postcatheter
ablation procedures: how to minimize complications? Minerva
cardioangiologica. 2011;59(2):171–86.
19. Berntzen H, Almås H, Bruun AMG, Dørve S, Giskemo A, Dåvøy
G, et al. Perioperativ og postoperativ sykepleie. In: Almås H,
Stubberud D, Grønset R, editors. Klinisk Sykepleie 1 4 utgave.
Oslo: Gyldendal Akademiske;
2010.





















0 Kommentarer